Астат
Астат (рус. астат, англ. Astatine, нем. Astat), At, неметаллический радиоактивный химический элемент, атомный номер 85, атомная масса 210. Относится к группе галогенов в природе встречается очень редко. Астат очень нестабилен, имеет много изотопов.
История
Впервые Астат был получен искусственно в 1940 Д. Корсоном, К. Р. Маккензи и Э. Сегре (Калифорнийский университет в Беркли). Для синтеза изотопа 211 At они облучали висмут альфа-частицами.
В 1943 – 1946 изотопы астата были обнаружены в составе природных радиоактивных элементов.
Происхождение названия
Греч.– быть неустойчивым. Через его радиоактивный распад.
Распространение
Редкий. В поверхностном слое земной коры толщиной 1,6 км содержится около 70 мг астата. Изотопы астата радиоактивные, они недовгоживучи, и период их полураспада составляет 5-8 часов.
Получение
Получают облучением металлического висмута или тория ?-частицами высокой энергии с последующим отделением астата соосаждения, экстракции, хроматографии или дистилляцией на платиновую пластинку.
 .
.Свойства
Физические свойства
Ввиду малого количества доступной для изучения вещества, физические свойства этого элемента плохо изучены и, как правило, построены на аналогиях с более доступными элементами.
Астат – твердое вещество сине-черного цвета, по внешнему виду похож на йод. Для него характерно сочетание свойств неметаллов (галогенов) и металлов (полоний, свинец и т.д.). Как и йод, астат хорошо растворяется в органических растворителях и легко ими экстрагируется. По летучести немного уступает йода, но также может легко возгоняется.
Температура плавления 302 ° C, кипения (сублимации) 337 ° C.
Химические свойства
По свойствам астат всего напоминает йод: перегоняется, экстрагируется четыреххлористым углеродом CCl 4 из водных растворов, восстанавливается цинком или сернистым газом до астатид-иона At -:
 ,
,который с ионами серебра образует нерастворимый астатид серебра AgAt. Последний количественно спивоосаджуеться с йодидом серебра в качестве носителя. Астатат ион AtO 3 - образуется при окислении астатид-иона йодной кислотой H 5 IO 6 или церием Ce (IV):

Формализованный запись этого уравнения соответствует условию электронейтральности. Фактически ионы Ce (IV) существуют в виде гидратированных ионов [Ce (H 2 O) n] 4, отщепляют ион водорода и, за исключением очень кислых растворов (рН ~ 1), далее подвергаются гидролизу и полимеризации. Ионы AtO 3 - количественно спивоосаджуеться с нерастворимыми в воде Pb (IO 3) 2.
Применение
Биологическая роль
Даже физиологически астат ведет себя подобно йода, например, концентрируется в щитовидной железе. Поскольку астат сопровождает йод, то это позволяет наряду с препаратами йода вводить радиоактивный астат и использовать его при радиотерапии раковых опухолей.
Смотри также
Литература
Малая горная энциклопедия. В 3-х т. / Под ред. В. С. Белецкого. – М.: «Донбасс», 2004. – .
 Просмотров: 3682
Просмотров: 3682
 Дата: 26-12-2010
Дата: 26-12-2010
Галогены
Галогены (рус. галогены, англ. Halogens, нем. Halogene n pl) – химические элементы: фтор F, хлор Cl, бром Br, йод J и астат At. Молекулы двухатомные. Реагируют с большинством элементов образуя
ПОДРОБНЕЕ
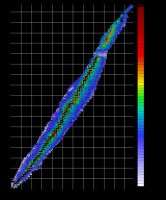
Изотопы
Распределение изотопов. По горизонтали – заряд ядра (число протонов). По вертикали – атомная масса (число нуклонов). Цвет – стабильность изотопа (продолжительность полураспада). Изотопы – нуклиды
ПОДРОБНЕЕ
Прометий
Прометий (рус. прометий, англ. Promethium, нем. Promethium n) – радиоактивный химический элемент. Символ Pm, ао. н. 61; ат. г. 145,0. Относится к лантаноидов. Известно 14 изотопов с мас. числом
ПОДРОБНЕЕ
Протактиний
Протактиний (рус. протактиний, англ. Protactinium, нем. Protaktinium n) – радиоактивный химический элемент. Символ Pa, атомный номер 91. Общая характеристика Атомная масса 231,0359. Относится к
ПОДРОБНЕЕ
Калифорний
Калифорний (Cf) – искусственно полученный радиоактивный химический элемент; относится к актиноидов. Известно 15 изотопов, самый стабильный – 251 Cf – имеет период полураспада 900 лет. История
ПОДРОБНЕЕ
Менделевий
Менделевий – 101 элемент периодической таблицы. Нестабилен. Приобретается искусственно. Известны 15 изотопов. Самый стабильный изотоп 258 Md живет примерно 51 день. История Впервые синтезирован в
ПОДРОБНЕЕ