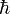Изотопы
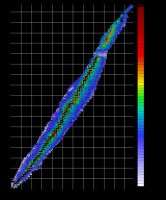 Распределение изотопов.
Распределение изотопов.По горизонтали – заряд ядра (число протонов).
По вертикали – атомная масса (число нуклонов).
Цвет – стабильность изотопа (продолжительность полураспада). Изотопы – нуклиды одного и того же химического элемента, имеющие разную атомную массу.
Изотопы обозначают теми же символами, что и химический элемент, добавляя сверху слева символа число, показывающее массу данного изотопа, выраженной в углеродных единицах, например, изотопы хлора обозначают: 35 Cl и 37 Cl, или массовое число следует за названием или символом элемента, например: уран-233 или Pu-239.
Изотопы данного химического элемента имеют одинаковый заряд атомного ядра, то есть один порядковый номер, и занимают то же место в периодической системе, имеют одинаковое количество протонов в ядре атома, но отличаются друг от друга количеством нейтронов. Так, в атомном ядре изотопа хлора 35 Cl содержится 17 протонов, поскольку порядковый номер хлора 17, и 18 нейтронов (35-17 = 18), а в ядре изотопа хлора 37 Cl – 17 протонов и 20 нейтронов (37-17 = 20).
Некоторые химические элементы имеют небольшое количество изотопов. Так, для кислорода известны три изотопа: 16 O (ядро состоит из 8 протонов и 8 нейтронов), 17 O (ядро состоит из 8 протонов и 9 нейтронов) и 18 В (ядро состоит из 8 протонов и 10 нейтронов). Для водорода известно тоже три изотопа: 1 H (ядро состоит только из одного протона), 2 H (ядро состоит из одного протона и одного нейтрона), 3 H (ядро состоит из одного протона и двух нейтронов). Некоторые же химические элементы состоят из достаточно большого количества изотопов. Например, ксенон имеет 9 изотопов, олово – 10 и т. д.
Подавляющее большинство изотопов не имеет специальных названий, но для изотопов некоторых элементов, в частности для изотопов водорода, существуют специальные названия и даже специальные символы. Так, изотоп водорода 1 H называют протей, изотоп 2 H – дейтерий и обозначают символом D а изотоп 3 Н – тритий (символ T). Некоторые изотопы в природе достаточно распространены, как, например, изотоп кислорода 16 O и изотоп водорода 1 Н, а остальные изотопы встречаются в очень мизерных количествах, как изотопы кислорода 17 O и 18 O и изотопы водорода 2 H и 3 H.
По химическим свойствам все изотопы данного элемента очень близки, поэтому разницы между ними при химических реакциях не проводят. Исключение составляют изотопы водорода, которые по своим свойствам заметно отличаются друг от друга.
Атомная масса изотопа, выраженная в углеродных единицах, называется его массовым числом. Массовые числа изотопов являются целыми числами.
 Просмотров: 5447
Просмотров: 5447
 Дата: 25-02-2011
Дата: 25-02-2011
Атомная масса
Атомная масса (m a), которую также называют «относительной атомной массой», является массой одного атома изотопа, выраженной в атомных единицах массы, а.е.м., в которых изотоп углерод-12 имеет
ПОДРОБНЕЕ
Ядро атома
Ядро – центральная часть атома. В ядре сосредоточены положительный электрический заряд и основная часть массы атома. По сравнению с размерами атома, который определяется радиусом электронных орбит,
ПОДРОБНЕЕ
Ядерная физика
Ядерная физика – раздел физики, изучающий структуру и свойства атомных ядер, и механизмы ядерных реакций (в том числе радиоактивный распад). Задачи, возникающие в ядерной физике, – это типичный
ПОДРОБНЕЕ
Радий
Радий (рус. рад, англ. Radium, нем. Radium n) – радиоактивный химический элемент. Символ Ra, ат. н. 88; ат. м. для наиболее устойчивого изотопа 226 Ra (период полураспада около 1620) – 226,0254.
ПОДРОБНЕЕ
Унунквадий
Получение элемента было подтверждено в 2004 и в 2006 гг в Объединенном институте ядерных исследований совместно с Ливерморской национальной лаборатории (США). Открытие передано и IUPAC, но ею не
ПОДРОБНЕЕ
Химический элемент
Химический элемент – тип (вид, сорт) атомов с одинаковым зарядом атомных ядер (т.е. одинаковым количеством протонов в ядре атома) и определенной совокупностью свойств, но масса ядра атома химического
ПОДРОБНЕЕ