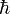Химический элемент
Химический элемент – тип (вид, сорт) атомов с одинаковым зарядом атомных ядер (т.е. одинаковым количеством протонов в ядре атома) и определенной совокупностью свойств, но масса ядра атома химического элемента может быть различной, в зависимости от количества нейтронов в нем. Совокупность атомов элемента с одинаковой массой называется нуклидом, а изотопами называются атомы одного элемента с разными массами. Атомы данного химического элемента отличаются от атомов других элементов величиной заряда ядра, количеством и характером размещения электронов вокруг ядра, размерами и химическими свойствами. В нейтрального атома число электронов на электронных оболочках равен заряду ядра.
Количество атомов химического элемента не изменяется при химических реакциях. Для превращения атома одного химического элемента в другой необходимые ядерные реакции. В частности, с помощью ядерных реакций получают новые химические элементы, которые не существуют в природе. На 2010 год было известно 118 химических элементов: из них 89 обнаружены в природе, другие получены искусственно в результате ядерных реакций.
История
Впервые понятие химического элемента сформулировал Роберт Бойль в 1661 году. Срок элемент имеет в своей основе представления древних о первичных стихии, из которых по их мнению состояла материя: вода, воздух, земля, огонь. Бойль назвал химическими элементами вещества, которые никоим образом нельзя было разложить на простые. Он также показал, что таких химических элементов больше, чем четыре. В 1789 году Лавуазье опубликовал список 33 известных в то время элементов, к которым он также включил свет и теплорода. К 1818 году Барцелиус определил атомные массы 45-и 49-и признанных в то время химических элементов. В периодической таблице, которую составил Менделеев было 66 химических элементов. В 1913 году Генри Мозли открыл то, что атомный номер химического элемента совпадает с зарядом его ядра.
Кроме 89-и химических элементов, обнаруженных в природе, другие получены искусственно в результате ядерных реакций (атомы технеция, прометию, протактиния, нобелию в сверхмалых количествах были обнаружены в урановых и ториевых минералах.
Атомный номер
Ядро атома состоит из протонов (число которых соответствует атомному числу химического элемента) и нейтронов; число последних может быть различным. Атомы химических элементов с одинаковым числом протонов, но разным числом нейтронов называются изотопами. По своим химическим свойствам изотопы химических элементов практически не отличаются между собой.
Атом с конкретным числом протонов и нейтронов называется нуклидом. Нуклид характеризуется массовым числом – общим числом нуклонов.
Химические символы и названия
Все химические элементы обозначают специальными символами – одной или двумя латинскими буквами, причем первая буква всегда велика, а вторая имела. Например, водород обозначающие символ H, серу – символом S, железо – символом Fe, кислород – символом O и т.д. Современные символы химических элементов были введены в химию в начале XIX в.
Каждый химический символ означает, во-первых, название элемента, во-вторых, при записях формул химических реакций – один атом этого элемента. Химические символы служат также для составления химических формул веществ.
Нуклиды обозначают символом химического элемента с передним верхним индексом, равным массовом числу, например, 12 C означает нуклид углерода с 12-ю нуклонами, из которых 6 протонов и 6 нейтронов.
Кроме номера каждый химический элемент имеет название, сложилась исторически. Системой наименований химических соединений занимается Международный союз фундаментальной и прикладной химии (IUPAC). С целью унификации химических названий IUPAC разработал рекомендации латинизированный названий химических элементов, утвержденный в Украине ДСТУ 2439-94. Определенные настоящим стандартом названия должны употребляться в научной литературе. Таким образом, некоторые из химических элементов имеют два названия – латинизированную и историческую, украинская. Например, название водород является научным названием водорода, мышьяк является научным названием мышьяка.
Названия химических элементов по ГОСТ 2439-94 вместе с историческими названиями приведены в алфавитном показателе в конце статьи.
Изотопы
Химические элементы могут иметь несколько изотопов. Для изотопов хранятся названия и символы химических элементов, исключения составляют только изотопы водорода, которые имеют собственные названия и обозначения – 1 Н-против, 2 Н (D) – дейтерий, 3 Н (Т) – тритий. Химические элементы, которые имеют стабильные нуклиды, в природе представлены одним или несколькими изотопами. Известно около 270 стабильных изотопов, принадлежащих 81 природному химическому элементу, и более 1800 радионуклидов. Химические элементы, все изотопы которых радиоактивны, называются радиоактивными элементами. К ним относятся технеций, прометий, полоний и все элементы с атомным номером, большим чем 84.
Атомная масса
Природный изотопный состав химических элементов, встречающихся на Земле, практически постоянный, поэтому каждый элемент имеет определенную атомную массу, которая является одной из важнейших его характеристик. Атомная масса химического элемента равна среднему значению масс всех его природных изотопов с учетом распространенности последних. Ее обычно выражают в атомных единицах массы, за которую принята 1 / 12 часть массы нуклида 12 С.
Простые вещества
Формам существования химических элементов в природе соответствуют простые вещества. По ДСТУ 2439-94 названия простых веществ могут не совпадать с названиями химических элементов. Например, химический элемент водород существует в природе в виде газа водорода, молекула которого состоит из двух атомов водорода.
Элемент может существовать в виде нескольких простых веществ (явление аллотропия), отличающихся друг от друга составом молекул (например, для химического элемента кислорода простыми веществами являются кислород О 2 и озон O 3) или типом кристаллической решетки (например, модификации углерода – алмаз, лонсдейлит, графит; явление полиморфизма). Число веществ простых превышает 500. Сложное вещество – химическое соединение, состоящее из химически связанных атомов двух или более различных элементов. Известно более 100 тысяч неорганических и более 3 млн. органических соединений.
Каждый элемент характеризуется степенями окисления, который могут проявлять атомы данного элемента в химических соединениях, а также значением электроотрицательности, характеризующая способность атоме химического элемента отдавать и принимать электроны. В химических реакциях химические элементы сохраняются, так как в результате происходит лишь перераспределение электронов внешних электронных оболочек атомов, а ядра атомов остаются неизменными.
Периодическая система элементов
Подробнее в статье Периодическая система элементов
По химическим свойствам химических элементов их можно упорядочить в периодическую систему.
Первый перечень химических элементов составил в 1789 г. французский химик А. Л. Лавуазье. В этот список вошли 25 известных в то время элементов. Первую таблицу относительных атомных масс пяти химических елентив (кислород, азот, углерод, сера и фосфор) составил английский ученый Дж. Дальтон в 1803 г. Ко времени открытия периодического закона (1869 г.) было известно 63 элемента. Обобщение закона выполнили параллельно Д. Менделеев и Ю. Майер. Открытие периодической системы позволило предсказать существование, а также свойства ряда неизвестных в то время химических элементов и послужило научной основой для их классификации. Успехи ядерного физики позволили в ХХ в. уточнить понятие химического элемента и синтезировать новые.
Химические элементы, принадлежащие к одной группе имеют близкие химические свойства, а потому их объединяет в семьи:
щелочных металлов – литий, натрий, калий, рубидий, цезий, франций;
щелочноземельных металлов – кальций, стронций, барий, радий;
халькогенов – кислород, сера (сульфур), селен, теллур, полоний;
галогены – фтор, хлор, бром, йод, астат;
инертные газы (благородные газы) – гелий, неон, аргон, криптон, ксенон, радон.
Элементы третьей группы периодической системы с последовательными номерами, вынесены в отдельные строки периодической системы, объединенные в отдельные группы
лантаноидов – лантан, церий, празеодим, неодим, прометий, самарий, европий, гадолиний, тербий, диспрозий, Хольм, эрбия, тулий, иттербий, лютеций;
актиноидов – актиний, торий, протактиний, уран, нептуний, плутоний, америций, кюрий, берклий, калифорний, эйнштейний, фермы, Менделевий, Нобель, лоуренсий;
Существуют также другие объединения химических элементов в отдельные семьи по их свойствам, например,
семья железа – железо, кобальт, никель;
семья платины, к которой относятся благородные металлы – рутений, родий, палладий, осмий, иридий, платина.
По своим свойствам химические элементы делятся также на металлы и неметаллы. К неметаллов принадлежат 23 элементы (Н, В, С, N, О, Si, Р, S, As, Se, Те и др.), галогены (F, CI, Br, I, At), инертные газы (Не, Ne, Ar, Kr, Хе, Rn) к металлам – остальные 86 химических элементов. Для химических свойств металлов наиболее характерна способность отдавать внешние электроны и образовывать катионы, для неметаллов – присоединять электроны и образовывать анионы. Электроотрицательность металлов, как правило, от 0,7 до 1,8-2,0; неметаллов от 1,8-2,0 до 4,0.
Происхождение химических элементов
Подробнее в статье нуклеосинтез
По современным представлениям, первым химическим элементом, образовавшийся после Большого Взрыва был водород. Это произошло тогда, когда первичная плазма остыла настолько, что протоны стали присоединять к себе электроны, формируя нейтральные атомы. Тяжелые химические элементы образовались в недрах звезд, где большая плотность и высокая температура привели протеканию термоядерных реакций. При взрывах сверхновых тяжелые химические элементы выбрасывались в межзвездное пространство. Именно эти тяжелые элементы стали строительным материалом при стрворенни планет, в частности Земли.
Распространение химических элементов
Распространенность химических элементов различна во Вселенной и на Земле. Самым распространенным элементом во Вселенной есть простейший химический элемент водород, ядро которого состоит из одного протона. Водород – основной элемент в межзвездном пространстве и в недрах звезд, в которых он превращается в гелий и другие химические элементы результате реакций ядерного синтеза. Распространенность тяжелых химических элементов быстро уменьшается с ростом их атомного номера.
В условиях Земли ситуация совсем другая. Гравитационное поле Земли недостаточно сильно, чтобы удержать водород в атомном или молекулярном состоянии. Поэтому водород на Земле может существовать только в составе химических соединений с тяжелыми элементами. То же касается и гелия, которого на Земле также мало.
Наиболее распространенный на Земле кислород, на долю которого приходится 47,2% массы земной коры. За ним следуют кремний – 27,6, алюминий – 8,8, феррум – 5,1, кальций – 3,6, натрий – 2,6, калий – 2,6 и магний – 2,1%. Итого на эти восемь элементов приходится 99,6% массы земной коры, а на остальные – только 0,4%.
Химические элементы, концентрация которых в земной коре низкая, либо они практически не образуют собственных минералов (благодаря изоморфно вхождению в минералы более распространенных элементов), называются рассеянными.
Алфавитный указатель химических элементов
Примечания:
Агрегатное состояние простого вещества указанный для нормальных условий
Название по ГОСТ 2439-94 указана только тогда, когда она отличается от общеупотребительного названия
Смотри также
Список химических элементов
Аллотропия
Валентность
Периодическая система
Простое вещество
Сложное вещество
радиоактивные элементы
Рассеянные элементы
Атмофильни элементы
Редкоземельные элементы
Литофильные элементы
Самородные элементы
Элементы-индикаторы
Редкие элементы
Геохимическая классификация элементов
Количество атомов химического элемента не изменяется при химических реакциях. Для превращения атома одного химического элемента в другой необходимые ядерные реакции. В частности, с помощью ядерных реакций получают новые химические элементы, которые не существуют в природе. На 2010 год было известно 118 химических элементов: из них 89 обнаружены в природе, другие получены искусственно в результате ядерных реакций.
История
Впервые понятие химического элемента сформулировал Роберт Бойль в 1661 году. Срок элемент имеет в своей основе представления древних о первичных стихии, из которых по их мнению состояла материя: вода, воздух, земля, огонь. Бойль назвал химическими элементами вещества, которые никоим образом нельзя было разложить на простые. Он также показал, что таких химических элементов больше, чем четыре. В 1789 году Лавуазье опубликовал список 33 известных в то время элементов, к которым он также включил свет и теплорода. К 1818 году Барцелиус определил атомные массы 45-и 49-и признанных в то время химических элементов. В периодической таблице, которую составил Менделеев было 66 химических элементов. В 1913 году Генри Мозли открыл то, что атомный номер химического элемента совпадает с зарядом его ядра.
Кроме 89-и химических элементов, обнаруженных в природе, другие получены искусственно в результате ядерных реакций (атомы технеция, прометию, протактиния, нобелию в сверхмалых количествах были обнаружены в урановых и ториевых минералах.
Атомный номер
Ядро атома состоит из протонов (число которых соответствует атомному числу химического элемента) и нейтронов; число последних может быть различным. Атомы химических элементов с одинаковым числом протонов, но разным числом нейтронов называются изотопами. По своим химическим свойствам изотопы химических элементов практически не отличаются между собой.
Атом с конкретным числом протонов и нейтронов называется нуклидом. Нуклид характеризуется массовым числом – общим числом нуклонов.
Химические символы и названия
Все химические элементы обозначают специальными символами – одной или двумя латинскими буквами, причем первая буква всегда велика, а вторая имела. Например, водород обозначающие символ H, серу – символом S, железо – символом Fe, кислород – символом O и т.д. Современные символы химических элементов были введены в химию в начале XIX в.
Каждый химический символ означает, во-первых, название элемента, во-вторых, при записях формул химических реакций – один атом этого элемента. Химические символы служат также для составления химических формул веществ.
Нуклиды обозначают символом химического элемента с передним верхним индексом, равным массовом числу, например, 12 C означает нуклид углерода с 12-ю нуклонами, из которых 6 протонов и 6 нейтронов.
Кроме номера каждый химический элемент имеет название, сложилась исторически. Системой наименований химических соединений занимается Международный союз фундаментальной и прикладной химии (IUPAC). С целью унификации химических названий IUPAC разработал рекомендации латинизированный названий химических элементов, утвержденный в Украине ДСТУ 2439-94. Определенные настоящим стандартом названия должны употребляться в научной литературе. Таким образом, некоторые из химических элементов имеют два названия – латинизированную и историческую, украинская. Например, название водород является научным названием водорода, мышьяк является научным названием мышьяка.
Названия химических элементов по ГОСТ 2439-94 вместе с историческими названиями приведены в алфавитном показателе в конце статьи.
Изотопы
Химические элементы могут иметь несколько изотопов. Для изотопов хранятся названия и символы химических элементов, исключения составляют только изотопы водорода, которые имеют собственные названия и обозначения – 1 Н-против, 2 Н (D) – дейтерий, 3 Н (Т) – тритий. Химические элементы, которые имеют стабильные нуклиды, в природе представлены одним или несколькими изотопами. Известно около 270 стабильных изотопов, принадлежащих 81 природному химическому элементу, и более 1800 радионуклидов. Химические элементы, все изотопы которых радиоактивны, называются радиоактивными элементами. К ним относятся технеций, прометий, полоний и все элементы с атомным номером, большим чем 84.
Атомная масса
Природный изотопный состав химических элементов, встречающихся на Земле, практически постоянный, поэтому каждый элемент имеет определенную атомную массу, которая является одной из важнейших его характеристик. Атомная масса химического элемента равна среднему значению масс всех его природных изотопов с учетом распространенности последних. Ее обычно выражают в атомных единицах массы, за которую принята 1 / 12 часть массы нуклида 12 С.
Простые вещества
Формам существования химических элементов в природе соответствуют простые вещества. По ДСТУ 2439-94 названия простых веществ могут не совпадать с названиями химических элементов. Например, химический элемент водород существует в природе в виде газа водорода, молекула которого состоит из двух атомов водорода.
Элемент может существовать в виде нескольких простых веществ (явление аллотропия), отличающихся друг от друга составом молекул (например, для химического элемента кислорода простыми веществами являются кислород О 2 и озон O 3) или типом кристаллической решетки (например, модификации углерода – алмаз, лонсдейлит, графит; явление полиморфизма). Число веществ простых превышает 500. Сложное вещество – химическое соединение, состоящее из химически связанных атомов двух или более различных элементов. Известно более 100 тысяч неорганических и более 3 млн. органических соединений.
Каждый элемент характеризуется степенями окисления, который могут проявлять атомы данного элемента в химических соединениях, а также значением электроотрицательности, характеризующая способность атоме химического элемента отдавать и принимать электроны. В химических реакциях химические элементы сохраняются, так как в результате происходит лишь перераспределение электронов внешних электронных оболочек атомов, а ядра атомов остаются неизменными.
Периодическая система элементов
Подробнее в статье Периодическая система элементов
По химическим свойствам химических элементов их можно упорядочить в периодическую систему.
Первый перечень химических элементов составил в 1789 г. французский химик А. Л. Лавуазье. В этот список вошли 25 известных в то время элементов. Первую таблицу относительных атомных масс пяти химических елентив (кислород, азот, углерод, сера и фосфор) составил английский ученый Дж. Дальтон в 1803 г. Ко времени открытия периодического закона (1869 г.) было известно 63 элемента. Обобщение закона выполнили параллельно Д. Менделеев и Ю. Майер. Открытие периодической системы позволило предсказать существование, а также свойства ряда неизвестных в то время химических элементов и послужило научной основой для их классификации. Успехи ядерного физики позволили в ХХ в. уточнить понятие химического элемента и синтезировать новые.
Химические элементы, принадлежащие к одной группе имеют близкие химические свойства, а потому их объединяет в семьи:
щелочных металлов – литий, натрий, калий, рубидий, цезий, франций;
щелочноземельных металлов – кальций, стронций, барий, радий;
халькогенов – кислород, сера (сульфур), селен, теллур, полоний;
галогены – фтор, хлор, бром, йод, астат;
инертные газы (благородные газы) – гелий, неон, аргон, криптон, ксенон, радон.
Элементы третьей группы периодической системы с последовательными номерами, вынесены в отдельные строки периодической системы, объединенные в отдельные группы
лантаноидов – лантан, церий, празеодим, неодим, прометий, самарий, европий, гадолиний, тербий, диспрозий, Хольм, эрбия, тулий, иттербий, лютеций;
актиноидов – актиний, торий, протактиний, уран, нептуний, плутоний, америций, кюрий, берклий, калифорний, эйнштейний, фермы, Менделевий, Нобель, лоуренсий;
Существуют также другие объединения химических элементов в отдельные семьи по их свойствам, например,
семья железа – железо, кобальт, никель;
семья платины, к которой относятся благородные металлы – рутений, родий, палладий, осмий, иридий, платина.
По своим свойствам химические элементы делятся также на металлы и неметаллы. К неметаллов принадлежат 23 элементы (Н, В, С, N, О, Si, Р, S, As, Se, Те и др.), галогены (F, CI, Br, I, At), инертные газы (Не, Ne, Ar, Kr, Хе, Rn) к металлам – остальные 86 химических элементов. Для химических свойств металлов наиболее характерна способность отдавать внешние электроны и образовывать катионы, для неметаллов – присоединять электроны и образовывать анионы. Электроотрицательность металлов, как правило, от 0,7 до 1,8-2,0; неметаллов от 1,8-2,0 до 4,0.
Происхождение химических элементов
Подробнее в статье нуклеосинтез
По современным представлениям, первым химическим элементом, образовавшийся после Большого Взрыва был водород. Это произошло тогда, когда первичная плазма остыла настолько, что протоны стали присоединять к себе электроны, формируя нейтральные атомы. Тяжелые химические элементы образовались в недрах звезд, где большая плотность и высокая температура привели протеканию термоядерных реакций. При взрывах сверхновых тяжелые химические элементы выбрасывались в межзвездное пространство. Именно эти тяжелые элементы стали строительным материалом при стрворенни планет, в частности Земли.
Распространение химических элементов
Распространенность химических элементов различна во Вселенной и на Земле. Самым распространенным элементом во Вселенной есть простейший химический элемент водород, ядро которого состоит из одного протона. Водород – основной элемент в межзвездном пространстве и в недрах звезд, в которых он превращается в гелий и другие химические элементы результате реакций ядерного синтеза. Распространенность тяжелых химических элементов быстро уменьшается с ростом их атомного номера.
В условиях Земли ситуация совсем другая. Гравитационное поле Земли недостаточно сильно, чтобы удержать водород в атомном или молекулярном состоянии. Поэтому водород на Земле может существовать только в составе химических соединений с тяжелыми элементами. То же касается и гелия, которого на Земле также мало.
Наиболее распространенный на Земле кислород, на долю которого приходится 47,2% массы земной коры. За ним следуют кремний – 27,6, алюминий – 8,8, феррум – 5,1, кальций – 3,6, натрий – 2,6, калий – 2,6 и магний – 2,1%. Итого на эти восемь элементов приходится 99,6% массы земной коры, а на остальные – только 0,4%.
Химические элементы, концентрация которых в земной коре низкая, либо они практически не образуют собственных минералов (благодаря изоморфно вхождению в минералы более распространенных элементов), называются рассеянными.
Алфавитный указатель химических элементов
Примечания:
Агрегатное состояние простого вещества указанный для нормальных условий
Название по ГОСТ 2439-94 указана только тогда, когда она отличается от общеупотребительного названия
Смотри также
Список химических элементов
Аллотропия
Валентность
Периодическая система
Простое вещество
Сложное вещество
радиоактивные элементы
Рассеянные элементы
Атмофильни элементы
Редкоземельные элементы
Литофильные элементы
Самородные элементы
Элементы-индикаторы
Редкие элементы
Геохимическая классификация элементов
 Просмотров: 10101
Просмотров: 10101
 Дата: 25-12-2010
Дата: 25-12-2010
Простые вещества
Простые вещества (рус. вещества простые, англ. Elementary substances, нем. Einfache Stoffe m pl) – вещества молекулы которых состоят из атомов одного и того же химического элемента. Например, к
ПОДРОБНЕЕ
Изотопы
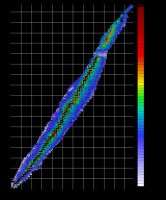
Распределение изотопов. По горизонтали – заряд ядра (число протонов). По вертикали – атомная масса (число нуклонов). Цвет – стабильность изотопа (продолжительность полураспада). Изотопы – нуклиды
ПОДРОБНЕЕ
Атомная масса
Атомная масса (m a), которую также называют «относительной атомной массой», является массой одного атома изотопа, выраженной в атомных единицах массы, а.е.м., в которых изотоп углерод-12 имеет
ПОДРОБНЕЕ
Аллотропия
Аллотропные состояния углерода: алмаз и графит Аллотропия (от гр. ?????, allos – другой и ??????, tropos – свойство) – явление, когда химический элемент существует в виде двух или нескольких простых
ПОДРОБНЕЕ
Ядро атома
Ядро – центральная часть атома. В ядре сосредоточены положительный электрический заряд и основная часть массы атома. По сравнению с размерами атома, который определяется радиусом электронных орбит,
ПОДРОБНЕЕ
Ядерная физика
Ядерная физика – раздел физики, изучающий структуру и свойства атомных ядер, и механизмы ядерных реакций (в том числе радиоактивный распад). Задачи, возникающие в ядерной физике, – это типичный
ПОДРОБНЕЕ