Молекула водорода
Эта статья посвящена квантово-механической теории образования ковалентной связи в молекуле водорода. Подробнее о химических свойствах молекулы водорода можно прочитать в статье Водород.
Молекула водорода – простейшая химическая молекула, состоящая из двух атомов водорода. В ее состав входят два ядра химического элемента водорода и два электрона. Вследствие взаимодействия между электронами образуется ковалентная химическая связь. Кроме основной изотопического модификации H 2, существуют разновидности, в которых один или оба протии заменены другими изотопами водорода – дейтерием и тритием: HD, HT, D 2, DT, T 2. Симметричность или несиметричнисть молекулы играет роль при ее вращении.
Квантово-механическую теорию ковалентной связи в молекуле водорода разработали в 1927 году Вальтер Гайтлера и Фриц Лондон.
Гамильтониан молекулы водорода H 2 записывается в виде

 ,
,
где M – масса протона, m – масса электрона, – Координаты ядер,
– Координаты ядер,  – Координаты электронов.
– Координаты электронов.
В адиабатическом приближении задача о нахождении энергетических состояний молекулы водорода разбивается на два этапа. На первом этапе рассматривается только электронная подсистема, а ядра считаются зафиксированными в точках и
и  .
.
Гамильтониан электронной подсистемы имеет вид
Mathbf {r} _2 |} "src =" http://upload.wikimedia.org/math/2/c/9/2c9...41b1fb1aaec.png "/>,
Гамильтониан молекулы водорода симметричен относительно переменных и
и  , Т.е. не изменяется нумерации электронов. Кроме того он не зависит от спиновых переменных.
, Т.е. не изменяется нумерации электронов. Кроме того он не зависит от спиновых переменных.
 Схематическое изображение симметричной волновой функции молекулы водорода и образования ковалентной связи
Схематическое изображение симметричной волновой функции молекулы водорода и образования ковалентной связи  Схематическое изображение антисимметричной волновой функции молекулы водорода Исходя из принципа Тождественные частиц и учитывая то, что электроны – фермионы, волновая функция молекулы водорода должна быть антисимметричной относительно перестановки электронов. Независимость гамильтониана от спиновых переменных позволяет выбрать ее в виде произведения двух функций, одна из которых зависит только от координат и называется координатной волновой функцией, а вторая зависит только от спинов и называется спиновой функцией.
Схематическое изображение антисимметричной волновой функции молекулы водорода Исходя из принципа Тождественные частиц и учитывая то, что электроны – фермионы, волновая функция молекулы водорода должна быть антисимметричной относительно перестановки электронов. Независимость гамильтониана от спиновых переменных позволяет выбрать ее в виде произведения двух функций, одна из которых зависит только от координат и называется координатной волновой функцией, а вторая зависит только от спинов и называется спиновой функцией.
Существуют два возможных типа спиновых функций для двух электронов: с параллельными спинами и антипараллельными спинами. Функции с параллельными спинами симметричны относительно перестановки электронов и образуют триплетные состояния, в которых суммарный спин равен единице. Функции по антипараллельными спинами образуют синглетные состояния с нулевым суммарным спином. Они антисимметрична относительно перестановки электронов.
Поскольку волновая функция электрона должна быть антисиметиричною относительно перестановки, то она может быть произведением или
Симметричная и антисимметричная координатные функции основного состояния в нулевом приближении теории возмущений можно построить, исходя из волновых функций основного состояния атома водорода (Смотрите Волновая фукнции основного состояния атома водорода).
(Смотрите Волновая фукнции основного состояния атома водорода).
Первый член каждой из приведенных волновых функций отвечает локализации электрона, пронумерованного индексом 1, на атоме с Индеси 1, а электрона, пронумерованного индексом 2, на атоме с индексом 2. Второй член соответствует ситуации, когда первый электрон принадлежит второму атому, а второй – первому. При изменении нумерации электронов первая (симметричная) функция не меняется, вторая (антисимметричная) – меняет знак.
Энергия электронных состояний находится усреднением гамильтониана на волновых функциях
 .
.
Для двух возможных волновых функций основного состояния она принимает вид
 ,
,
где – Расстояние между ядрами, E 1 s – значения энергии основного состояния атома водорода, S – интеграл перекрытия, который определяется выражением
– Расстояние между ядрами, E 1 s – значения энергии основного состояния атома водорода, S – интеграл перекрытия, который определяется выражением
 ,
,
Q – кулоновский интеграл, равный
 ,
,
A – обменный интерграл, равный

 .
.
Энергия молекулы водорода состоит из удвоенной энергии атома водорода, энергии кулоновского отталкивания между ядрами и членов, определяющих взаимодействие электронов между собой и с другим ядром. В зависимости от спинового состояния в формуле для нужно выбирать знак «+» или знак «-». Знак «+» соответствует синглетном состояния, знак «-» – триплентому.
нужно выбирать знак «+» или знак «-». Знак «+» соответствует синглетном состояния, знак «-» – триплентому.
Величина Q (R) это средняя энергия кулоновского взаимодействия между двумя электронами и электронов с «чужим ядром». Величина A (R) – определяет вклад в энергию обменного взаимодействия, аналога которой в классической физике нет. Именно этот член определяет существенное различие между синглетный и триплетного состояния.
Ковалентная связь
 Энергия взаимодействия атомов в молекуле водорода для синглетного (сплошная линия) и триплетного (штриховая линия) состояний. Обменный интеграл для молекулы водорода в определенном диапазоне расстояний между атомы отрицателен. Как следствие, для синглетных состояний он обеспечивает дополнительное притяжение между ядрами атомов, а для триплетных – дополнительное отталкивание. Дополнительное привлечение предопределяет появление минимума электронной энергии на расстоянии примерно в полтора радиусов Бора (что соответствует примерно 75 пм). Этот минимум возникает только для синглетного состояния, то есть для антипараллельных спинов. Таким образом устанавливается ковалентная связь между атомами. Электроны двух атомов водорода «спариваются».
Энергия взаимодействия атомов в молекуле водорода для синглетного (сплошная линия) и триплетного (штриховая линия) состояний. Обменный интеграл для молекулы водорода в определенном диапазоне расстояний между атомы отрицателен. Как следствие, для синглетных состояний он обеспечивает дополнительное притяжение между ядрами атомов, а для триплетных – дополнительное отталкивание. Дополнительное привлечение предопределяет появление минимума электронной энергии на расстоянии примерно в полтора радиусов Бора (что соответствует примерно 75 пм). Этот минимум возникает только для синглетного состояния, то есть для антипараллельных спинов. Таким образом устанавливается ковалентная связь между атомами. Электроны двух атомов водорода «спариваются».
Длина связи в молекуле водорода составляет 74,14 пм, а энергия связи – 453,6 кДж / моль. Интересно, что длина связи в молекуле, состоящей из двух атомов дейтерия 2 Н (нуклида водорода) остается практически той же, тогда как энергия связи меньше и составляет 447,3 кДж / моль.
Насыщение ковалентной связи
Для параллельных спинов, т.е. для триплетного состояния, дополнительный положительный вклад в энергию приводит к тому, что атомы отталкиваются на любой расстоянии. Этим объясняется насыщения ковалентной связи. Молекула водорода может скаладатися только из двух атомов. Третий атом водорода не может установить связь с молекулой, поскольку его спин непременно будет параллельным хотя бы одному из спинов электронов в составе молекулы. Параллельность спинов приводит к видштовухування между ядрами на любой расстоянии.
Необходимо отметить, что на большой расстояния между атомами они привлекаются в любых состояниях благодаря ван-дер-ваальсовых взаимодействия, которая, однако, гораздо слабее ковалентий связь. Ван-дер-ваальсовых взаимодействие не учитывается в приведенной теории, поскольку требует рассмотрения возбужденных состояний превышающих 1s-орбиталь.
Гамильтониан, описывающий относительное движение двух ядер в молекуле водорода имеет вид
 ,
,
где ? = M / 2 – сводная масса двух ядер, – Зависящая от расстояния между ядрами энергия синглетного электронного состояния, определенная в предыдущем разделе.
– Зависящая от расстояния между ядрами энергия синглетного электронного состояния, определенная в предыдущем разделе.  – Оператор углового момента, который описывает вращение молекулы.
– Оператор углового момента, который описывает вращение молекулы.
Вращения
Оператор углового момента коммутирует с гамильтонианом, поэтому собственные фунции гамильтониана можно выбрать совместными с собственными функциями оператора углового момента, то есть сферическими гармониками:
 .
.
Вклад вращения в энергию молекулы равна
 .
.
Этот вклад мал, потому массы ядер набат большие от массы электрона. Он зависит от расстояния между ядрами R. При колебаниях ядер это расстояние меняется, поэтому вращательный момент, строго говоря, невозможно отделить от колеблющегося. Однако при малых l и при малых энергиях колебательного движения, можно считать R равняется определенному среднему значению.
Вращающиеся уровне вырожденные по «магнитного квантового числа» m l. Кратность вырождения 2l +1.
Колебания атомов
В окрестности минимимуму функцию можно разложить в ряд Тейлора, ограничившись лишь квадратичным членом.
можно разложить в ряд Тейлора, ограничившись лишь квадратичным членом.
 ,
,
где

Таким образом задача о энергетические состояния колебания ядер сводится к задаче гармонического осциллятора. Следовательно, при для низких колебательных и вращающихся уровней энергия молекулы водорода равна
 ,
,
где – Колеблющиеся квантовое число.
– Колеблющиеся квантовое число.
Низкая энергия колебания отвечает нулевым колебаниям.
отвечает нулевым колебаниям.
При больших значениях квантвових чисел n и l колеблющийся и вращательное движение разделить невозможно.
Таким образом, энергию молекулы при малых квантовых числах можно записать в виде трех слагаемых – электронного, колебательного и вращательного:
E s, n, l = E e l + E v + E r
Малым параметром задачи является отношение массы электрона к массе протона. Электронный слагаемое не зависит от этого отношения, колеблющийся пропорционален , Крутящий пропорционален m / M. Поэтому
, Крутящий пропорционален m / M. Поэтому
 .
.
Как следствие электронный уровень расщепляется на несколько колеблющихся, каждый из которых в свою очередь расщепляется на вращающиеся. Поскольку энергии вращающихся уровней близки, то в оптических спектрах они сливаются в полосы – возникает полосатый спектр, который наблюдается для молекулы HD – для симметричной молекулы H 2 переходы между орбитальными и колеблющимися уровнями запрещены правилами отбора, поэтому она не поглощает в инфракрасной области.
 Схематическое изображение спиновых изомеров водорода Ядра атомов водорода, входящие в сладу молекулы, являются протонами – фермионами со спином 1 / 2. По правилам сложения спинов суммарный ядерный спин молекулы может быть 0 или 1. Молекулы водорода с суммарным ядерным спином 0 называют параводнем, молекулы водорода с суммарным ядерным спином 1 и тремя возможными проекциями: -1, 0, 1, называют ортоводнем. В состоянии термодинамического равновесия при комнатной температуре, отношения между ортоводнем и параводнем составляет 3:1. Однако при низких температурах в состоянии термодинамического равновесия, молекулы параводню доминируют благодаря различным вращательным свойствам: параводень является симметричным ротатором, ортоводень – несимметричным ротатором. Переход ортоводню в параводень – медленный процесс, и состояние термодинамического равновесия при низких температурах устанавливается долго.
Схематическое изображение спиновых изомеров водорода Ядра атомов водорода, входящие в сладу молекулы, являются протонами – фермионами со спином 1 / 2. По правилам сложения спинов суммарный ядерный спин молекулы может быть 0 или 1. Молекулы водорода с суммарным ядерным спином 0 называют параводнем, молекулы водорода с суммарным ядерным спином 1 и тремя возможными проекциями: -1, 0, 1, называют ортоводнем. В состоянии термодинамического равновесия при комнатной температуре, отношения между ортоводнем и параводнем составляет 3:1. Однако при низких температурах в состоянии термодинамического равновесия, молекулы параводню доминируют благодаря различным вращательным свойствам: параводень является симметричным ротатором, ортоводень – несимметричным ротатором. Переход ортоводню в параводень – медленный процесс, и состояние термодинамического равновесия при низких температурах устанавливается долго.
Молекула водорода – простейшая химическая молекула, состоящая из двух атомов водорода. В ее состав входят два ядра химического элемента водорода и два электрона. Вследствие взаимодействия между электронами образуется ковалентная химическая связь. Кроме основной изотопического модификации H 2, существуют разновидности, в которых один или оба протии заменены другими изотопами водорода – дейтерием и тритием: HD, HT, D 2, DT, T 2. Симметричность или несиметричнисть молекулы играет роль при ее вращении.
Квантово-механическую теорию ковалентной связи в молекуле водорода разработали в 1927 году Вальтер Гайтлера и Фриц Лондон.
Гамильтониан молекулы водорода H 2 записывается в виде

 ,
,где M – масса протона, m – масса электрона,
 – Координаты ядер,
– Координаты ядер,  – Координаты электронов.
– Координаты электронов.В адиабатическом приближении задача о нахождении энергетических состояний молекулы водорода разбивается на два этапа. На первом этапе рассматривается только электронная подсистема, а ядра считаются зафиксированными в точках
 и
и  .
.Гамильтониан электронной подсистемы имеет вид
Mathbf {r} _2 |} "src =" http://upload.wikimedia.org/math/2/c/9/2c9...41b1fb1aaec.png "/>,
Гамильтониан молекулы водорода симметричен относительно переменных
 и
и  , Т.е. не изменяется нумерации электронов. Кроме того он не зависит от спиновых переменных.
, Т.е. не изменяется нумерации электронов. Кроме того он не зависит от спиновых переменных. Схематическое изображение симметричной волновой функции молекулы водорода и образования ковалентной связи
Схематическое изображение симметричной волновой функции молекулы водорода и образования ковалентной связи  Схематическое изображение антисимметричной волновой функции молекулы водорода Исходя из принципа Тождественные частиц и учитывая то, что электроны – фермионы, волновая функция молекулы водорода должна быть антисимметричной относительно перестановки электронов. Независимость гамильтониана от спиновых переменных позволяет выбрать ее в виде произведения двух функций, одна из которых зависит только от координат и называется координатной волновой функцией, а вторая зависит только от спинов и называется спиновой функцией.
Схематическое изображение антисимметричной волновой функции молекулы водорода Исходя из принципа Тождественные частиц и учитывая то, что электроны – фермионы, волновая функция молекулы водорода должна быть антисимметричной относительно перестановки электронов. Независимость гамильтониана от спиновых переменных позволяет выбрать ее в виде произведения двух функций, одна из которых зависит только от координат и называется координатной волновой функцией, а вторая зависит только от спинов и называется спиновой функцией.Существуют два возможных типа спиновых функций для двух электронов: с параллельными спинами и антипараллельными спинами. Функции с параллельными спинами симметричны относительно перестановки электронов и образуют триплетные состояния, в которых суммарный спин равен единице. Функции по антипараллельными спинами образуют синглетные состояния с нулевым суммарным спином. Они антисимметрична относительно перестановки электронов.
Поскольку волновая функция электрона должна быть антисиметиричною относительно перестановки, то она может быть произведением или
Симметричная и антисимметричная координатные функции основного состояния в нулевом приближении теории возмущений можно построить, исходя из волновых функций основного состояния атома водорода
 (Смотрите Волновая фукнции основного состояния атома водорода).
(Смотрите Волновая фукнции основного состояния атома водорода).Первый член каждой из приведенных волновых функций отвечает локализации электрона, пронумерованного индексом 1, на атоме с Индеси 1, а электрона, пронумерованного индексом 2, на атоме с индексом 2. Второй член соответствует ситуации, когда первый электрон принадлежит второму атому, а второй – первому. При изменении нумерации электронов первая (симметричная) функция не меняется, вторая (антисимметричная) – меняет знак.
Энергия электронных состояний находится усреднением гамильтониана на волновых функциях
 .
.Для двух возможных волновых функций основного состояния она принимает вид
 ,
,где
 – Расстояние между ядрами, E 1 s – значения энергии основного состояния атома водорода, S – интеграл перекрытия, который определяется выражением
– Расстояние между ядрами, E 1 s – значения энергии основного состояния атома водорода, S – интеграл перекрытия, который определяется выражением ,
,Q – кулоновский интеграл, равный
 ,
,A – обменный интерграл, равный

 .
.Энергия молекулы водорода состоит из удвоенной энергии атома водорода, энергии кулоновского отталкивания между ядрами и членов, определяющих взаимодействие электронов между собой и с другим ядром. В зависимости от спинового состояния в формуле для
 нужно выбирать знак «+» или знак «-». Знак «+» соответствует синглетном состояния, знак «-» – триплентому.
нужно выбирать знак «+» или знак «-». Знак «+» соответствует синглетном состояния, знак «-» – триплентому.Величина Q (R) это средняя энергия кулоновского взаимодействия между двумя электронами и электронов с «чужим ядром». Величина A (R) – определяет вклад в энергию обменного взаимодействия, аналога которой в классической физике нет. Именно этот член определяет существенное различие между синглетный и триплетного состояния.
Ковалентная связь
 Энергия взаимодействия атомов в молекуле водорода для синглетного (сплошная линия) и триплетного (штриховая линия) состояний. Обменный интеграл для молекулы водорода в определенном диапазоне расстояний между атомы отрицателен. Как следствие, для синглетных состояний он обеспечивает дополнительное притяжение между ядрами атомов, а для триплетных – дополнительное отталкивание. Дополнительное привлечение предопределяет появление минимума электронной энергии на расстоянии примерно в полтора радиусов Бора (что соответствует примерно 75 пм). Этот минимум возникает только для синглетного состояния, то есть для антипараллельных спинов. Таким образом устанавливается ковалентная связь между атомами. Электроны двух атомов водорода «спариваются».
Энергия взаимодействия атомов в молекуле водорода для синглетного (сплошная линия) и триплетного (штриховая линия) состояний. Обменный интеграл для молекулы водорода в определенном диапазоне расстояний между атомы отрицателен. Как следствие, для синглетных состояний он обеспечивает дополнительное притяжение между ядрами атомов, а для триплетных – дополнительное отталкивание. Дополнительное привлечение предопределяет появление минимума электронной энергии на расстоянии примерно в полтора радиусов Бора (что соответствует примерно 75 пм). Этот минимум возникает только для синглетного состояния, то есть для антипараллельных спинов. Таким образом устанавливается ковалентная связь между атомами. Электроны двух атомов водорода «спариваются».Длина связи в молекуле водорода составляет 74,14 пм, а энергия связи – 453,6 кДж / моль. Интересно, что длина связи в молекуле, состоящей из двух атомов дейтерия 2 Н (нуклида водорода) остается практически той же, тогда как энергия связи меньше и составляет 447,3 кДж / моль.
Насыщение ковалентной связи
Для параллельных спинов, т.е. для триплетного состояния, дополнительный положительный вклад в энергию приводит к тому, что атомы отталкиваются на любой расстоянии. Этим объясняется насыщения ковалентной связи. Молекула водорода может скаладатися только из двух атомов. Третий атом водорода не может установить связь с молекулой, поскольку его спин непременно будет параллельным хотя бы одному из спинов электронов в составе молекулы. Параллельность спинов приводит к видштовухування между ядрами на любой расстоянии.
Необходимо отметить, что на большой расстояния между атомами они привлекаются в любых состояниях благодаря ван-дер-ваальсовых взаимодействия, которая, однако, гораздо слабее ковалентий связь. Ван-дер-ваальсовых взаимодействие не учитывается в приведенной теории, поскольку требует рассмотрения возбужденных состояний превышающих 1s-орбиталь.
Гамильтониан, описывающий относительное движение двух ядер в молекуле водорода имеет вид
 ,
,где ? = M / 2 – сводная масса двух ядер,
 – Зависящая от расстояния между ядрами энергия синглетного электронного состояния, определенная в предыдущем разделе.
– Зависящая от расстояния между ядрами энергия синглетного электронного состояния, определенная в предыдущем разделе.  – Оператор углового момента, который описывает вращение молекулы.
– Оператор углового момента, который описывает вращение молекулы.Вращения
Оператор углового момента коммутирует с гамильтонианом, поэтому собственные фунции гамильтониана можно выбрать совместными с собственными функциями оператора углового момента, то есть сферическими гармониками:
 .
.Вклад вращения в энергию молекулы равна
 .
.Этот вклад мал, потому массы ядер набат большие от массы электрона. Он зависит от расстояния между ядрами R. При колебаниях ядер это расстояние меняется, поэтому вращательный момент, строго говоря, невозможно отделить от колеблющегося. Однако при малых l и при малых энергиях колебательного движения, можно считать R равняется определенному среднему значению.
Вращающиеся уровне вырожденные по «магнитного квантового числа» m l. Кратность вырождения 2l +1.
Колебания атомов
В окрестности минимимуму функцию
 можно разложить в ряд Тейлора, ограничившись лишь квадратичным членом.
можно разложить в ряд Тейлора, ограничившись лишь квадратичным членом. ,
,где

Таким образом задача о энергетические состояния колебания ядер сводится к задаче гармонического осциллятора. Следовательно, при для низких колебательных и вращающихся уровней энергия молекулы водорода равна
 ,
,где
 – Колеблющиеся квантовое число.
– Колеблющиеся квантовое число.Низкая энергия колебания
 отвечает нулевым колебаниям.
отвечает нулевым колебаниям.При больших значениях квантвових чисел n и l колеблющийся и вращательное движение разделить невозможно.
Таким образом, энергию молекулы при малых квантовых числах можно записать в виде трех слагаемых – электронного, колебательного и вращательного:
E s, n, l = E e l + E v + E r
Малым параметром задачи является отношение массы электрона к массе протона. Электронный слагаемое не зависит от этого отношения, колеблющийся пропорционален
 , Крутящий пропорционален m / M. Поэтому
, Крутящий пропорционален m / M. Поэтому .
.Как следствие электронный уровень расщепляется на несколько колеблющихся, каждый из которых в свою очередь расщепляется на вращающиеся. Поскольку энергии вращающихся уровней близки, то в оптических спектрах они сливаются в полосы – возникает полосатый спектр, который наблюдается для молекулы HD – для симметричной молекулы H 2 переходы между орбитальными и колеблющимися уровнями запрещены правилами отбора, поэтому она не поглощает в инфракрасной области.
 Схематическое изображение спиновых изомеров водорода Ядра атомов водорода, входящие в сладу молекулы, являются протонами – фермионами со спином 1 / 2. По правилам сложения спинов суммарный ядерный спин молекулы может быть 0 или 1. Молекулы водорода с суммарным ядерным спином 0 называют параводнем, молекулы водорода с суммарным ядерным спином 1 и тремя возможными проекциями: -1, 0, 1, называют ортоводнем. В состоянии термодинамического равновесия при комнатной температуре, отношения между ортоводнем и параводнем составляет 3:1. Однако при низких температурах в состоянии термодинамического равновесия, молекулы параводню доминируют благодаря различным вращательным свойствам: параводень является симметричным ротатором, ортоводень – несимметричным ротатором. Переход ортоводню в параводень – медленный процесс, и состояние термодинамического равновесия при низких температурах устанавливается долго.
Схематическое изображение спиновых изомеров водорода Ядра атомов водорода, входящие в сладу молекулы, являются протонами – фермионами со спином 1 / 2. По правилам сложения спинов суммарный ядерный спин молекулы может быть 0 или 1. Молекулы водорода с суммарным ядерным спином 0 называют параводнем, молекулы водорода с суммарным ядерным спином 1 и тремя возможными проекциями: -1, 0, 1, называют ортоводнем. В состоянии термодинамического равновесия при комнатной температуре, отношения между ортоводнем и параводнем составляет 3:1. Однако при низких температурах в состоянии термодинамического равновесия, молекулы параводню доминируют благодаря различным вращательным свойствам: параводень является симметричным ротатором, ортоводень – несимметричным ротатором. Переход ортоводню в параводень – медленный процесс, и состояние термодинамического равновесия при низких температурах устанавливается долго. Просмотров: 7306
Просмотров: 7306
 Дата: 25-02-2011
Дата: 25-02-2011
Химическая связь
Химическая связь – взаимодействие между атомами, которая удерживает их в молекуле или твердом теле. Химические связи являются результатом сложного взаимодействия электронов и ядер атомов и
ПОДРОБНЕЕ
Простые вещества
Простые вещества (рус. вещества простые, англ. Elementary substances, нем. Einfache Stoffe m pl) – вещества молекулы которых состоят из атомов одного и того же химического элемента. Например, к
ПОДРОБНЕЕ
Ковалентная связь
Ковалентная связь является формой химической связи, характерной особенностью которого является то, что задействованы атомы занимают одно или более совместных пар электронов, и вызывают их взаимное
ПОДРОБНЕЕ
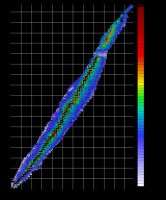
Изотопы
Распределение изотопов. По горизонтали – заряд ядра (число протонов). По вертикали – атомная масса (число нуклонов). Цвет – стабильность изотопа (продолжительность полураспада). Изотопы – нуклиды
ПОДРОБНЕЕ
Квантовая химия
Квантовая химия – междисциплинарная область науки, которая использует принципы квантовой механики для численных расчетов структур и свойств химических молекул. Методы квантовой химии позволяют
ПОДРОБНЕЕ
Никотинамид
Никотинамид, НАД, NAD - сложное органическое соединение, кофермент. Открытый в 1904 году английскими биохимиками А. Гарденом и У. Йонгом в экстракте дрожжей. Строение кофермента установлена в 1936 О.
ПОДРОБНЕЕ